Investigadores españoles cartografían la infección del cólera con detalle sin precedentes
Un estudio internacional liderado por el Consejo Superior de Investigaciones Científicas (CSIC) y el Instituto de Investigación Biomédica de Barcelona (IRB Barcelona) ofrece una explicación estructural muy detallada sobre cómo la bacteria Vibrio cholerae coloniza el intestino humano y produce la toxina del cólera, causante de diarrea potencialmente mortal. El trabajo, publicado en Science Advances, ha utilizado criomicroscopía electrónica para cartografiar el proceso de infección con un nivel de detalle sin precedentes, lo que abre nuevas vías para futuras terapias.
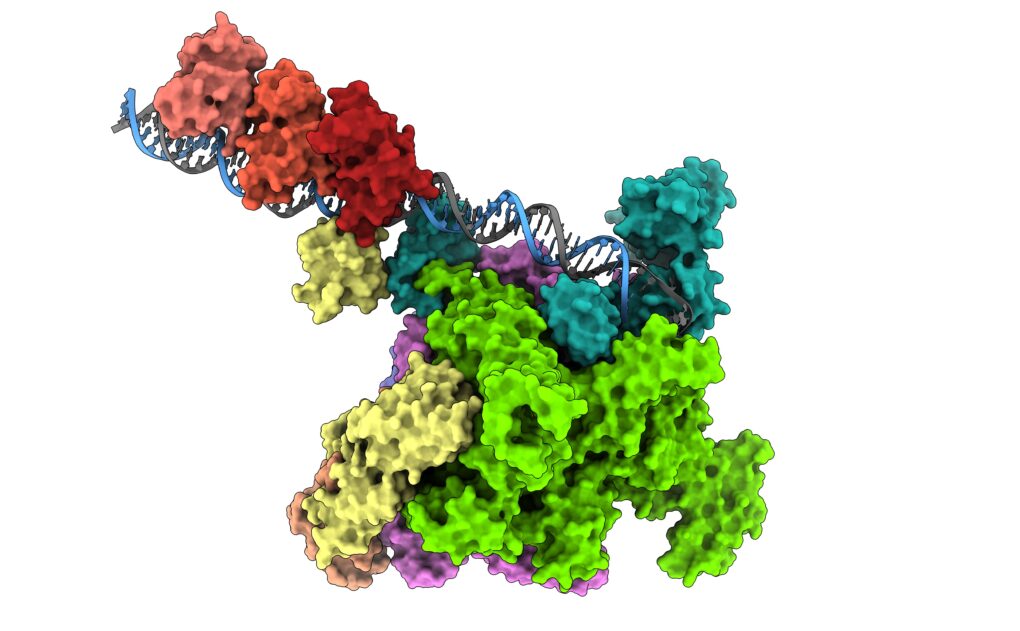
Aunque los interruptores moleculares que regulan la propagación de la bacteria en el intestino ya se conocían, hasta ahora no se comprendía cómo interactúan con la maquinaria de transcripción bacteriana, concretamente con la ARN polimerasa. El nuevo estudio revela la arquitectura molecular de esta interacción, mostrando que el mecanismo difiere de lo que se esperaba.
“Comprender esta interacción a nivel molecular nos da una nueva visión de cómo se controla la virulencia bacteriana”, explica Miquel Coll, investigador del CSIC en el Instituto de Biología Molecular de Barcelona (IBMB) y coordinador del estudio. En la investigación también han participado el Laboratorio Europeo de Biología Molecular (EMBL) de Heidelberg y un laboratorio de Estados Unidos.
El cólera continúa siendo un desafío global de salud pública, con entre 1,3 y 4 millones de casos anuales y decenas de miles de muertes reportadas en todo el mundo. La enfermedad se transmite principalmente a través de agua y alimentos contaminados, afectando de manera desproporcionada a regiones con acceso limitado a saneamiento seguro. Conflictos, cambio climático y desplazamiento poblacional están aumentando los brotes epidémicos, y la OMS clasificó el cólera como emergencia de grado 3, el nivel más alto de alerta, en 2023.
Estabilizando la maquinaria de transcripción
Los factores de transcripción ToxR y TcpP son claves para que la bacteria detecte señales externas, como la presencia de sales biliares en el intestino delgado humano. Una vez activados, se unen al ADN bacteriano y desencadenan una cascada regulatoria que produce la toxina del cólera y el pilus corregulado por toxinas, estructura filamentosa que permite a la bacteria adherirse al intestino.
Contrario a lo esperado, el estudio demuestra que ToxR y TcpP no remodelan la polimerasa para iniciar la transcripción. En su lugar, actúan como anclas moleculares, estabilizando una parte específica de la enzima (el dominio alfa-CTD) sobre el ADN, asegurando que el gen de virulencia se active de manera eficiente.
Además, los investigadores identificaron un único aminoácido, una fenilalanina, como puente crítico entre el factor de transcripción y la polimerasa. “Si se muta este aminoácido, todo el proceso de activación falla y las bacterias se vuelven inofensivas”, explica Adrià Alcaide, investigador del CSIC y primer autor del estudio.
Implicaciones para futuras terapias
El cólera puede provocar deshidratación mortal en pocas horas, especialmente en niños y personas mayores. Aunque la terapia de rehidratación y ciertos antibióticos reduce la mortalidad, algunas cepas ya presentan resistencia. La similitud molecular entre la ARN polimerasa de V. cholerae y E. coli sugiere que antibióticos existentes podrían ser optimizados para tratar el cólera, abriendo nuevas oportunidades terapéuticas.
Este descubrimiento supone un avance fundamental para entender la virulencia de Vibrio cholerae y podría marcar un antes y un después en el desarrollo de tratamientos contra esta enfermedad que sigue siendo una amenaza global.
Fuente: CSIC